
| 职 称: | 研究员 |
|---|---|
| 学 历: | 博士研究生 |
| 联系方式: | 86-27-68780901 |
| 电子邮件: | huangky#ihb.ac.cn(请改#为@) |
| 办 公 室: | 2号实验楼816 |
| 个人网页: |
简历介绍:
1988, 9-1992, 6 湖北大学; 理学学士学位; 生物学专业
1992, 7-1995, 8 郧阳师范专科学校; 讲师
1995, 9-1998, 9 武汉大学; 硕士学位; 遗传学专业
1998, 10-2004,4 德国FREIBURG 大学; 博士学位; 分子遗传专业
2004, 5-2009, 8 耶鲁大学分子、细胞及发育系; 博士后研究工作
2009, 9-2011,1 耶鲁大学; 合作研究科学家(Associate Research Scientist)
2011, 1-现在 中国科学院水生所研究员
研究内容
纤毛/鞭毛是指突出在真核细胞表面的一类毛发状细胞器,由微管组成的轴丝和外面包裹的纤毛膜组成。纤毛不仅存在于单细胞原生动物之中,也广泛存在于高等动物的细胞中。纤毛根据其轴丝的结构可分为9+2型运动纤毛和9+0型初级纤毛(图一)。纤毛的异常能导致一系列人类疾病,如男性不育、呼吸道疾病、肾囊肿、神经系统发育缺陷、眼盲、耳聋、肥胖症和癌症等,这些病统称为纤毛病。目前本实验室的研究重点是:
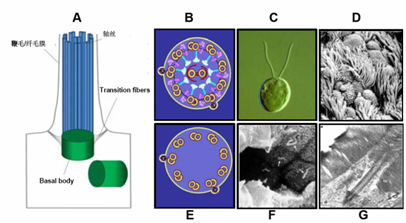
图一、鞭毛/纤毛的结构和类型。A,鞭毛/纤毛的结构,包括轴丝(Axoneme),鞭毛/纤毛膜(Ciliary membrane),与之相关的结构有基体(Basal Body)和Transition fibers。B,9+2型运动鞭毛/纤毛,如:衣藻的鞭毛(C)和呼吸道纤毛(D)。E,9+0型原纤毛,如肾表皮纤毛(F)和光受体细胞中连接纤毛(G)。(图A,D,F,G来源于Pedersen and Rosenbaum 2008 和Rosenbaum and Witman,2002.)
1. IFT蛋白复合体在基体组装
纤毛的形成、解聚和纤毛内信号传导依赖于鞭毛内运输机制(Intraflagellar Transport, IFT),耶鲁大学Joel Rosenbaum教授实验室的博士生Kozminski利用DIC显微镜首先在衣藻的鞭毛中观察到IFT运输(Kozminski et al.,1993)。IFT复合体在衣藻中有17种蛋白,分别组成IFT-A和IFT-B复合体, 从纤毛基部到顶端的正向(Anterograde) IFT运输由分子马达kinesin-2驱动,反向 (Retrograde)IFT运输的分子马达是dynein-2 。IFT蛋白在进化上非常保守,存在于所有具有纤毛的生物中。本学科组利用原生生物衣藻、动物细胞系、斑马鱼等模式生物来研究纤毛的形成及执行分泌功能的分子机理。
目前发现在纤毛中运动的IFT蛋白只占整个细胞全部IFT蛋白的20%,共聚焦显微镜下可观察到大量IFT蛋白聚集于纤毛的基体部位。在这个特定的区域,IFT-B复合体需要与参与纤毛组装的蛋白前体结合,在kinesin-2驱动下,将这些纤毛蛋白前体携带进入纤毛;IFT-A复合体在dynein-2驱动下将纤毛的解聚产物运出纤毛后,在基体部位需要与IFT-B组装,然后再次进入纤毛。我们最近的研究表明IFT-B复合体中的IFT52与IFT46在细胞质或内质网附近形成复合体,然后定位到基体(图二),否定了IFT蛋白复合体在基体组装的观点。下一步我们将深入研究IFT52在基体的定位机理;IFT-B、kinesin-2和纤毛前体蛋白超级复合体在基体的组装和定位;IFT-A、dynein-2和纤毛解聚蛋白超级复合体的解聚;以及IFT-A、IFT-B、kinesin-2和 dynein-2超级复合体超微结构。
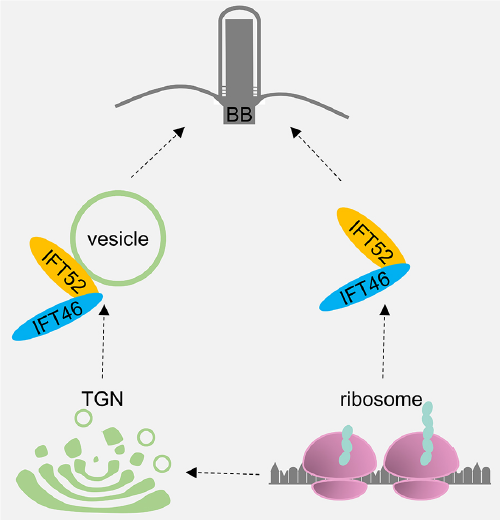
图二、IFT46基体定位的模型。新合成的IFT46与IFT52在细胞质或者高尔基体上预组装成复合体经由囊泡或者非囊泡介导的途径定位于基体。
2. 纤毛囊泡分泌的机理及功能
纤毛/鞭毛的功能分为三类:一是运动功能,单细胞真核生物衣藻利用鞭毛驱动细胞游动,哺乳动物上呼吸道中的纤毛通过有方向性运动将细菌和灰尘排出体外。二是感受功能,纤毛相当于细胞的天线,控制动物器官发生和动物发育的信号传导通路。最近的研究发现纤毛还具有分泌功能,纤毛囊泡(ciliary ectosome)能从纤毛膜上分泌出来,携带特异的酶和受体,在细胞间进行信号传导。
纤毛中的分泌功能首先是在模式生物衣藻中发现,在衣藻有丝分裂后期的母细胞中,子细胞纤毛可以分泌囊泡至胞外,囊泡上携带有用来降解母细胞壁的蛋白水解酶VLE(Vegetative Lytic Enzyme),将母细胞壁降解后释放出子细胞(Wood et al., 2013),该发现证明纤毛可以通过分泌途径与外界环境或其他细胞之间进行交流。进一步的研究表明在衣藻的交配过程中,纤毛囊泡还参与调节纤毛膜的蛋白组成、诱导配子出现mating反应(图三)(Cao et al., 2015)。最新的研究表明,哺乳动物细胞的初级纤毛在特定条件下可以分泌囊泡至胞外,参与调控细胞周期的进程(Phua et al., 2017)。哺乳动物细胞分泌的纤毛囊泡还与纤毛膜上的GPCR受体更新相关(Nager et al., 2017)。这些研究表明,纤毛囊泡的分泌是一种在进化上非常保守的细胞和细胞间进行物质运输和信号交流的途径,那么纤毛囊泡如何对蛋白进行分选?纤毛囊泡分泌的分子机理和调控机制是什么?是我们要回答的科学问题。
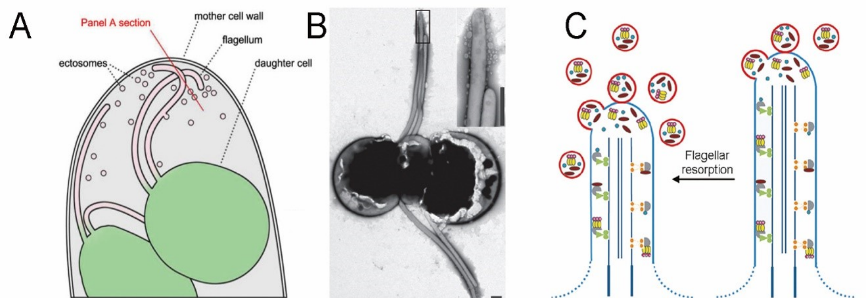
图三、纤毛的分泌功能存在于不同物种的纤毛中。A,有丝分裂过程中,衣藻纤毛分泌囊泡,其含有的活性蛋白酶用来降解母细胞壁,释放子细胞(Wood et al., 2013)。B,mating中的衣藻纤毛可从纤毛顶部分泌囊泡至胞外(Cao et al., 2015)。C,衣藻纤毛解聚过程中,纤毛囊泡的分泌量显著增加(Long et al., 2016)。
我们以莱茵衣藻为模式生物来研究纤毛的分泌功能。莱茵衣藻(Chlamydomonas reinhardtii)为单细胞、双鞭毛的真核绿藻。其核基因组约120 Mb,GC含量约为64% (Hoober, 1989),全基因组测序已于2007年完成(Merchant et al., 2007)。由于衣藻培养条件简单、生长周期短、遗传背景清晰、遗传转化技术成熟、易于获得基因敲降或敲除突变体,被广泛用于纤毛的形成与解聚、配子发生和交配等相关研究。此外,衣藻细胞体被细胞壁包裹,纤毛膜是唯一与外界接触的膜区域,这为纤毛囊泡的分离纯化提供便利。
本实验室在前期研究中成功分离纯化了衣藻在营养生长过程中分泌的纤毛囊泡,并对其蛋白组分与纤毛膜进行定量蛋白组学分析。证明纤毛囊泡虽然是从纤毛膜分泌至胞外,但它们具有特异的蛋白组分(Long et al., 2016)。其中富含蛋白水解酶、small GTPase、泛素化系统酶类等,此外,还含有3个ESCRT(内吞体运输分拣复合体,endosomal sorting complex required for transport)相关蛋白。通过进一步实验提出纤毛囊泡分泌的模型(图四):含有Late Assembly Domain的蛋白募集被泛素标记的蛋白、其他囊泡货物蛋白及ESCRT复合体蛋白,使ESCRT I复合体与纤毛囊泡的货物结合并在纤毛上形成一个膜突起,然后Alix/PDCD6与ESCRT I复合体结合并招募ESCRT II和ESCRT III,形成budding neck,最后VPS4复合体切断budding neck,使纤毛囊泡脱离纤毛膜。
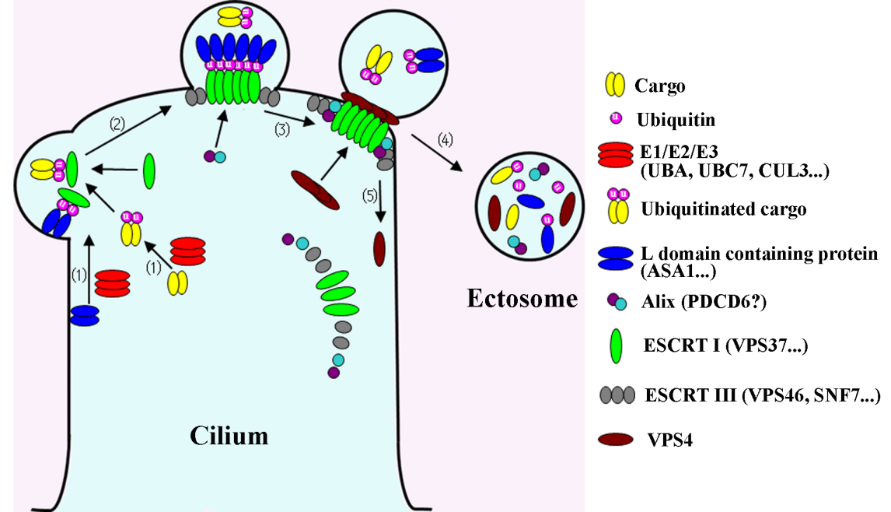
图四、纤毛囊泡分泌的分子模型
在今后的研究中,我们将利用超高分辨显微观察、BioID(Biotin Identification)、比较蛋白组学、功能域突变等方法,进一步深入研究ESCRT-I/II/III、泛素系统蛋白、small GTPase和actin相关蛋白协同介导纤毛囊泡分泌的分子机理。结合正向遗传学方法筛选获得纤毛囊泡分泌缺陷型突变体,鉴定新的纤毛囊泡分泌的调控因子,并解析其调控机制,为进一步弄清纤毛的分泌功能及其涉及的细胞生理过程打下基础。
3.微藻富集有机硒机理及有机硒产品的开发
硒是人体必须的微量元素之一。人体有25种硒蛋白,硒以硒代半胱氨酸的形式位于硒蛋白的酶活中心,硒蛋白在维持人体氧化还原平衡等方面起着重要的作用(Labunskyy et al.,2014)。动、植物在代谢过程中产生过氧化氢等活性氧,在体内使蛋白质和脂肪酸发生氧化,对生物膜和细胞造成损害,而硒蛋白具有清除体内自由基的功能;适量的硒具有提高机体免疫力的作用,提高免疫球蛋白和抗体的量,增强T细胞介导的特异性免疫。缺硒将导致机体某些代谢过程受阻,大量自由基积累而引发各种疾病。我国硒资源分布严重不均,大部分地区属于缺硒地区,如黑龙江、 吉林、 青海、 陕西、 四川和西藏等地严重缺硒。人工补硒有补充无机硒和有机硒两种途径。相对无机硒杂质多、利用率低、长期服用安全性差等副作用,有机硒具有吸收慢、毒性低、利用率高等优点。因此,人体服用有机硒更为安全。

图五、衣藻中的10种硒蛋白及真核生物中硒蛋白的合成机理
藻类对硒具有较强的富集能力,是硒有机化的良好载体。本实验室所用的模式生物衣藻是属于绿藻门的真核生物,具有类似于动物的硒蛋白翻译系统(Zhang et al.,2009)含有10种硒蛋白(Novoselov et al.,2002),且多与人类硒蛋白有同源性(图五)。本课题组将在研究硒蛋白在衣藻中的合成和功能的基础上,致力于富硒蛋白、富硒农作物、富硒功能性食品的开发。
参考文献
1)KozMINSKI K G, Johnson K A, Forscher P, et al. A motility in the eukaryotic flagellum unrelated to flagellar beating[J]. Proceedings of the National Academy of Sciences, 1993, 90(12): 5519-5523.
2)Wood C R, Huang K, Diener D R, et al. The cilium secretes bioactive ectosomes[J]. Current Biology, 2013, 23(10): 906-911.
3)Cao M, Ning J, Hernandez-Lara C I, et al. Uni-directional ciliary membrane protein trafficking by a cytoplasmic retrograde IFT motor and ciliary ectosome shedding[J]. Elife, 2015, 4: e05242.
4)Wang J, Silva M, Haas L A, et al. C. elegans ciliated sensory neurons release extracellular vesicles that function in animal communication[J]. Current Biology, 2014, 24(5): 519-525.
5)Wang J, Barr M M. Ciliary extracellular vesicles: txt msg organelles[J]. Cellular and molecular neurobiology, 2016, 36(3): 449-457.
6)Wang J, Kaletsky R, Silva M, et al. Cell-specific transcriptional profiling of ciliated sensory neurons reveals regulators of behavior and extracellular vesicle biogenesis[J]. Current Biology, 2015, 25(24): 3232-3238.
7)Long H, Zhang F, Xu N, et al. Comparative analysis of ciliary membranes and ectosomes[J]. Current Biology, 2016, 26(24): 3327-3335.
8)Hoober J K. The Chlamydomonas sourcebook: a comprehensive guide to biology and laboratory use[J]. Science, 1989, 246(4936): 1503-1505.
9)Merchant S S, Prochnik S E, Vallon O, et al. The Chlamydomonas genome reveals the evolution of key animal and plant functions[J]. Science, 2007, 318(5848): 245-250.
10) Labunskyy V M, Hatfield D L, Gladyshev V N. Selenoproteins: molecular pathways and physiological roles[J]. Physiological reviews, 2014, 94(3): 739-777.
11) Zhang Y, Gladyshev V N. Comparative genomics of trace elements: emerging dynamic view of trace element utilization and function[J]. Chemical reviews, 2009, 109(10): 4828-4861.
12) Novoselov S V, Rao M, Onoshko N V, et al. Selenoproteins and selenocysteine insertion system in the model plant cell system, Chlamydomonas reinhardtii[J]. The EMBO journal, 2002, 21(14): 3681-3693.
研究方向:
藻类细胞生物学
代表论著:
1) Lv B, Wan L, Taschner M, et al. Intraflagellar transport protein IFT52 recruits IFT46 to the basal body and flagella[J]. J Cell Sci, 2017, 130(9): 1662-1674.
2) Cheng X, Liu G, Ke W, et al. Building a multipurpose insertional mutant library for forward and reverse genetics in Chlamydomonas[J]. Plant methods, 2017, 13(1): 36.
3) Liu G, Huang K., Chlamydomonas: Intraflagellar transport, in MICROBIOLOGY MONOGRAPHS (Springer) of Chlamydomonas Biology, Biotechnology and Biomedicine (accepted)
4) Long H, Zhang F, Xu N, et al. Comparative analysis of ciliary membranes and ectosomes[J]. Current Biology, 2016, 26(24): 3327-3335.
5) Hochmal A K, Zinzius K, Charoenwattanasatien R, et al. Calredoxin represents a novel type of calcium-dependent sensor-responder connected to redox regulation in the chloroplast[J]. Nature communications, 2016, 7.
6) Chen J, Cui X, Jia S, et al. Disruption of dmc1 Produces Abnormal Sperm in Medaka (Oryzias latipes)[J]. Scientific reports, 2016, 6: 30912.
7) Gao X, Zhang F, Hu J, et al. MicroRNAs modulate adaption to multiple abiotic stresses in Chlamydomonas reinhardtii[J]. Scientific reports, 2016, 6: 38228.
8) Qin X, Huang Q, Xiao H, et al. The rice DUF1620-containing and WD40-like repeat protein is required for the assembly of the restoration of fertility complex[J]. New Phytologist, 2016, 210(3): 934-945.
9) Liu G, Huang K Y. Phosphorylation regulates the disassembly of cilia[J]. Science China. Life Sciences, 2015, 58(6): 621.
10) Long H, Wang Q, Huang K. Ciliary/flagellar protein ubiquitination[J]. Cells, 2015, 4(3): 474-482.
11) Wang R, Peng B, Huang K. The research progress of CO 2 sequestration by algal bio-fertilizer in China[J]. Journal of CO2 Utilization, 2015, 11: 67-70.
12) Li X C, Zhang J T, Wei W, et al. An overview on the special issue-The assessment of CO2 utilization technology in China[J]. 2015.
13) Hu J, Deng X, Shao N, et al. Rapid construction and screening of artificial microRNA systems in Chlamydomonas reinhardtii[J]. The Plant Journal, 2014, 79(6): 1052-1064.
14) Wood C R, Huang K, Diener D R, et al. The cilium secretes bioactive ectosomes[J]. Current Biology, 2013, 23(10): 906-911.
15) Long H, Huang K. Analysis of flagellar protein ubiquitination[J]. Methods Enzymol, 2013, 524: 59-73.
16) Huang K, Tsao C C. Importin-?: a key to two gates?[J]. Protein & cell, 2010, 1(9): 791-792.
17) Im C S, Eberhard S, Huang K, et al. Phototropin involvement in the expression of genes encoding chlorophyll and carotenoid biosynthesis enzymes and LHC apoproteins in Chlamydomonas reinhardtii[J]. The Plant Journal, 2006, 48(1): 1-16.
18) Huang K, Kunkel T, Beck C F. Localization of the blue-light receptor phototropin to the flagella of the green alga Chlamydomonas reinhardtii[J]. Molecular biology of the cell, 2004, 15(8): 3605-3614.
19) Huang K, Beck C F. Phototropin is the blue-light receptor that controls multiple steps in the sexual life cycle of the green alga Chlamydomonas reinhardtii[J]. Proceedings of the National Academy of Sciences, 2003, 100(10): 6269-6274.